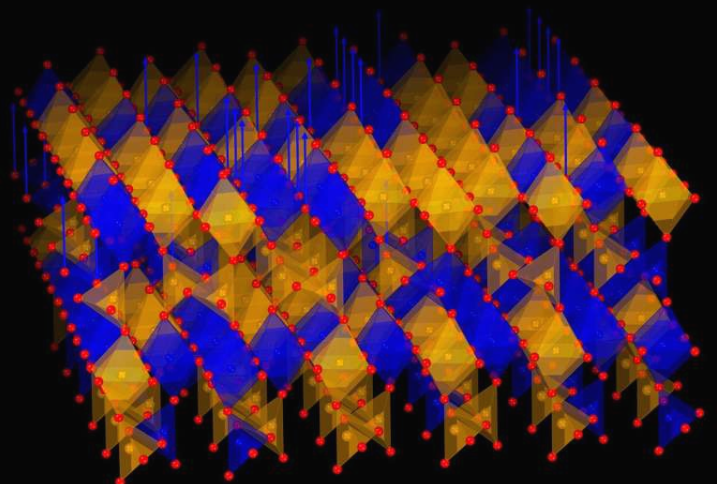
El equipo de investigación de la Universidad Estatal de Pensilvania verificó por primera vez, mediante simulaciones computacionales de alta resolución, la existencia de un nuevo mecanismo de plegamiento erróneo de proteínas a nivel atómico. Este estudio proporciona nuevas pistas para entender la asociación entre el plegamiento erróneo de proteínas y enfermedades como el Alzheimer y el Parkinson, con resultados publicados en la revista Science Advances. En simulaciones de plegamiento de proteínas de átomo completo, se observó un tipo de plegamiento erróneo de proteínas recientemente descubierto y persistente: enredos no naturales. Conformaciones representativas de plegamiento erróneo de la pequeña proteína ubiquitina y la proteína represora λ en simulaciones de plegamiento de átomo completo que muestran ganancia de enredo, y se muestran paralelas a sus estructuras nativas. En el estado de plegamiento erróneo, los lazos de enredo no natural se destacan en rojo, las esferas amarillas marcan el cierre del lazo, y las líneas azules indican el hilo que pasa a través del lazo.
El plegamiento erróneo de proteínas se refiere a la desviación de la ruta normal cuando la proteína forma su estructura tridimensional, lo que lleva a la pérdida de función o acumulación tóxica. El tipo de plegamiento erróneo descubierto en este estudio involucra anomalías en el "estado de enredo" interno de la proteína: es decir, la cadena de aminoácidos forma estructuras nudosas cuando no debería enredarse, o falla en enredarse cuando se necesita estabilidad. El equipo confirmó mediante simulaciones de átomo completo que este tipo de plegamiento erróneo es más propenso a persistir en proteínas más grandes, posiblemente evadiendo la detección del sistema de control de calidad celular.
El investigador principal, profesor de química Ed O'Brien, dijo: "El plegamiento erróneo de proteínas es la raíz de muchas enfermedades y también puede acelerar el envejecimiento. Nuestras simulaciones coinciden altamente con los datos experimentales, estableciendo las bases para el desarrollo de tratamientos dirigidos posteriores". El equipo combinó datos experimentales de espectrometría de masas y encontró que los cambios estructurales en las simulaciones eran consistentes con los resultados experimentales, apoyando aún más la fiabilidad de este mecanismo.
La primera autora del artículo, Quyen Vu, señaló que los plegamientos erróneos en proteínas pequeñas pueden repararse rápidamente, pero en proteínas de tamaño normal, debido a la complejidad estructural, los plegamientos erróneos son más propensos a persistir a largo plazo. Este descubrimiento ayuda a explicar el mecanismo de acumulación de proteínas mal plegadas en las células. O'Brien agregó: "Clarificar la universalidad y las características de estabilidad de este tipo de plegamiento erróneo impulsará la investigación de nuevas terapias para el envejecimiento y enfermedades neurodegenerativas".